STED显微技术介绍和应用
STED显微技术介绍和应用
1 STED显微技术的原理介绍
1.1.STED研究背景突破光学衍射极限的办法之一是近场光学显微镜,它是利用探针探测样品表面的隐失场而获得样品表面信息。2014年诺贝尔化学奖授予德国科学家Stefan W. Hell以及美国科学家Eric Betzig和William E. Moerner,以表彰他们在发展“超分辨荧光显微镜”方面做出的贡献。受激发射损耗(STED)荧光显微术是一种可以突破光学衍射极限的远场光学显微术。STED显微是一种先进的成像技术,超越了光学显微镜的传统限制,使研究人员能够在生物和材料科学中达到前所未有的分辨率水平。它是在20世纪90年代由Stefan W. Hell和他的同事所提出来的概念[1]。
1.2.STED原理
STED显微镜的基本原理包括使用两个激光束:一个甜甜圈形状的激发光束和一个中心抑制光束。当激发光照射样品时,光的衍射导致荧光分子在衍射斑范围内被激发。激发光使得电子跃迁到激发态,随后,一部分位于激发光斑外围的电子因为抑制光的影响通过受激发射回到基态。而位于激发光斑中心的电子则不受抑制光的影响,继续以自发荧光的方式返回基态。因此只有中心区域的荧光分子可自发辐射荧光,从而获得超衍射极限的荧光发光点。
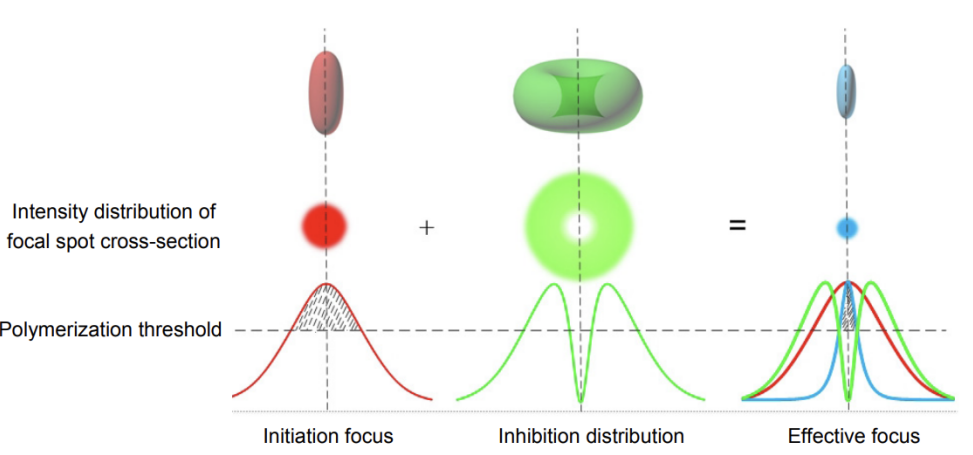
图1.STED双光束原理图[3]
理论上,STED显微镜的分辨率可以达到分子大小(荧光显微镜的极限)。在实际中,它受到信噪比的限制[2]。为了获得有效的分辨率增强,重要的是在整个样品中产生亚衍射荧光区域,并从所有这些区域中获得足够的荧光光子以获得良好的信噪比。信噪比取决于显微镜的检测效率,荧光团的亮度和光稳定性,以及光束的聚焦强度分布等原因。为了获得最大的信噪比,STED光束和激发光束的焦点必须符合纳米精度,并且残余STED光束在“零”强度点的强度必须最小化。
首先,通过一束激发光将艾里斑范围内的荧光分子从基态S0激发至较高振动态的第一激发态S0→S1*,其具体过程如图所示。随后,电子处于较高振动态时由于分子间的碰撞,激发态分子由同一电子能级中的较高振动能级转至较低振动能级,也就是会快速跃迁至第一激发态的最低振动态S1。接着,一束波长位于荧光发射谱低能级边缘的环形STED抑制光被用于退激发艾里斑周边的激发态荧光分子,使其跃迁至基态的较高振动态S1→S0*。由于振动弛豫速率远高于荧光辐射速率,处于S0振动态的电子会快速跃迁回S0,避免二次激发的发生,因此S1→S0的受激辐射过程占据绝对优势[4]。
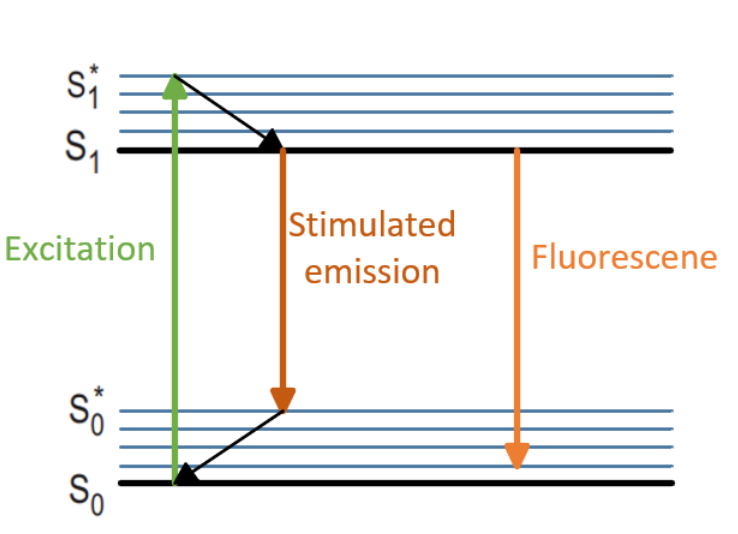
图2. 荧光分子受激辐射过程
根据受激辐射理论,受激吸收和受激辐射之间存在平等的竞争关系[5]。具体而言,平等的竞争关系就是指STED光对荧光分子产生受激吸收过程S0→S1和受激辐射过程S1→S0的概率是相同的。然而,由于振动弛豫速率远远高于荧光辐射速率,因此电子在S0*振动态中会快速跃迁回S0,避免发生二次激发。因此,在整个过程中,只有艾里斑中心的荧光分子处于最低激发态S1,才能通过自发荧光辐射跃迁至基态S0并发射荧光[6]。
STED显微镜与生物成像中常用的各种荧光团具有兼容性。它已广泛应用于细胞生物学、神经科学和材料科学,使研究人员能够研究细胞结构和亚细胞细胞器的细节。此外,STED显微镜在推进我们对动态细胞过程和分子相互作用的理解方面发挥了重要作用。
2 STED实际应用
2.1. 在微生物学中的应用
在科学研究的不断深入中,我们对微生物如细菌和病毒的了解不断加深。以往,人们普遍认为细菌内的遗传物质等是随机分布的,但现在我们认识到细菌体内存在特定的区域,染色体有明确的分工,骨架也在不断变化。然而,传统的光学显微镜对于揭示细菌内部结构和生理过程显得力不从心,难以分辨,更别提病毒这样尺寸更小的微粒的结构和表面蛋白的分布研究了。电子显微镜虽然有着出色的分辨率,但其成像条件却十分苛刻,容易破坏微生物的结构特征,从而影响实验结果。因此,STED光学超分辨显微技术将极大地推动对细菌、病毒等微生物的深入研究。
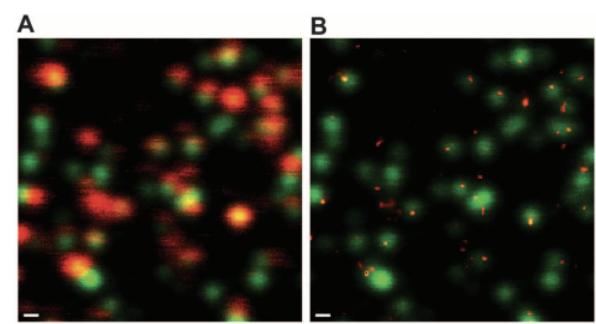
图3. (A).共聚焦显微镜模式下成熟粒子的环境信号。(B).与 (A)相同的视场,在STED模式下获得病毒包膜(Env)信号[7]2012年,Chojnacki等利用STED显微镜对艾滋病病毒(HIV-1)表面的病毒包膜(Env)的分布进行了研究,研究结果如图3所示。未成熟或部分成熟的HIV-1颗粒在Env蛋白结构或组成上没有明显差异,但其进入效率降低,这种效应可能是由于病毒膜下未成熟Gag晶格的硬度限制了膜融合,超分辨率荧光显微镜提供了一个机会来分析亚病毒结构的统计显著数量的颗粒。
2.2. 神经细胞内的亚细胞结构研究突触是神经信息传递的基本单元,其结构与功能紧密相连。因此,深入了解其结构特征有助于更全面地理解其功能。超分辨显微镜的问世使得对突触结构的研究更加直观而深入。例如,通过应用STED超分辨成像技术,我们可以观察到小鼠发生脆性X染色体综合征(FXS)时树突棘的头和颈部形态发生的变化。这是一种X连锁不完全外显性遗传病。患者表现为智力低下、巨睾、特殊面容、语言行为障碍等。
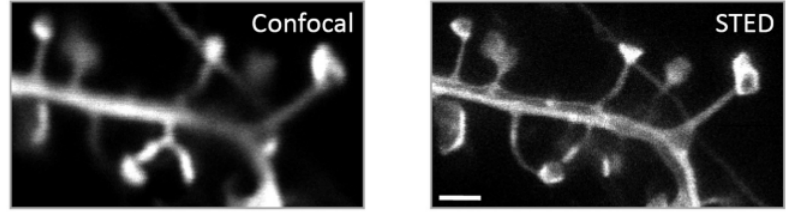
图4.树突棘共聚焦成像与通过使用STED成像[8]STED显微技术还展示了活细胞中树突棘的结构特征以及活体海马组织切片中突触顶端的结构等,如上图4所示结构,能够明显看出STED显微的分辨率有所提高。这些研究为我们提供了更清晰、更详细的突触结构信息,为进一步揭示其功能提供了有力的工具。
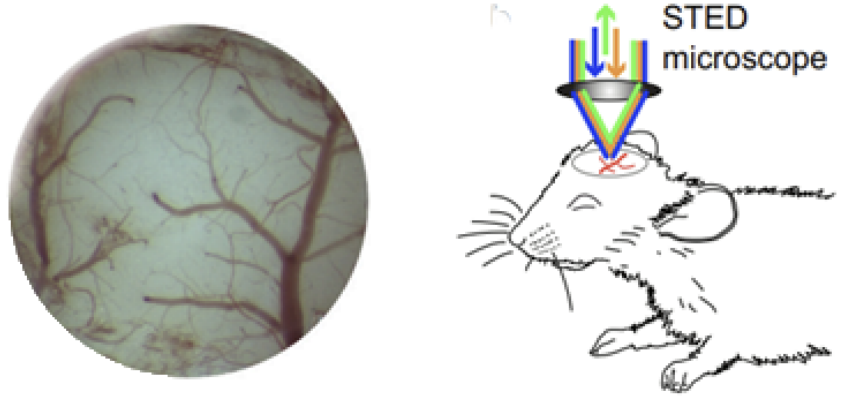
图5. 活体小鼠视觉皮层中肌动蛋白微丝的STED超分辨成像图[10]
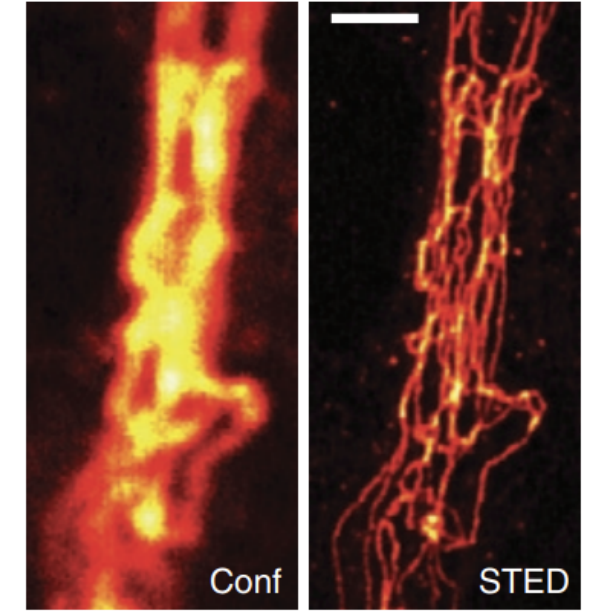
图6. 哺乳动物细胞中免疫标记的波形蛋白共聚焦(Conf)和STED图像的比较[11]
除此以外,STED显微镜技术凭借其较高的时间-空间分辨率,在活体成像方面也获得了较大进展。例如,2008年,Hell等利用STED显微镜成功观察到活体小鼠大脑皮层中神经元结构及其精细的动力学过程。后来,2014年,Willig等进一步提高STED显微镜活体成像水平,在成像深度大于40 μm的活体小鼠中获得43~70 nm的成像分辨率,如图5所示,并直观地观察到活体中神经元的肌动蛋白微丝的分布和形态。通过免疫标记的波形蛋白共聚焦和STED图像的对比也能够看出来STED的成像分辨率的提升。这些应用突出了STED显微镜在推进我们对纳米尺度生物和材料相关现象的理解方面的多功能性和影响。这项技术仍然是研究人员推动显微镜分辨率界限的宝贵工具。
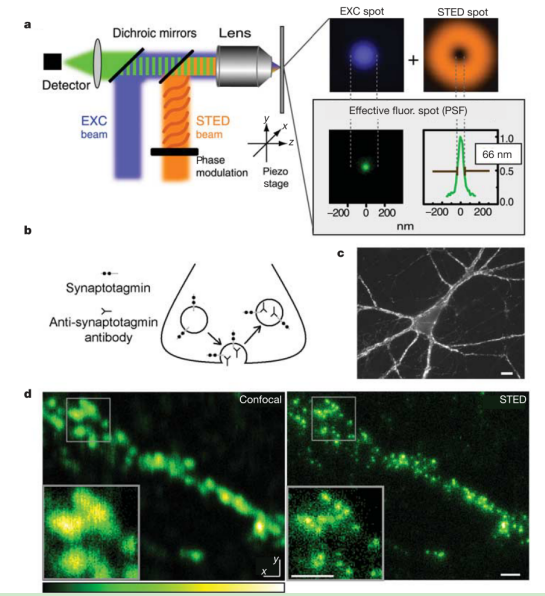
图7.STED显微镜显示了原代培养海马神经元单个钮扣中的突触囊泡[12]a.STED光和激发光重叠产生有效荧光点原理图b.表示了突触标记机制,允许其腔内突触联合蛋白结构域结合抗突触联合蛋白抗体。这些抗体在胞吞作用时被内化。d.标记制剂的共聚焦(左)和STED(右)对应图像的比较显示STED显著提高了分辨率。比例尺:500纳米。突触传递是由神经递质介导的,在突触传递的过程中,神经递质的释放和接收是关键步骤。当神经冲动到达突触前端时,电信号将导致突触前端的囊泡释放神经递质。神经递质储存在突触囊泡中,激活后通过胞吐释放。然后囊泡膜通过内吞作用恢复,突触囊泡再生并重新充满神经递质。虽然囊泡循环的许多方面都被理解,但融合后囊泡的命运仍然不清楚。它们的成分是在质膜上扩散,还是保持在一起, 这个问题很难回答,因为突触囊泡太小(直径40纳米),而且太密集,用现有的荧光显微镜无法分辨。如图7 a中介绍了STED光和激发光重叠的原理图。图7 d中进行了传统共聚焦和STED的对比,能够看出STED的分辨率更加清晰。在这里,Willig等使用受激发射损耗(STED)将焦点光斑面积减少了约一个数量级,低于衍射极限,从而解决了突触中的单个囊泡。
3 总结
总体而言,STED显微技术的发展为生命科学和材料科学领域的研究提供了一种强大的工具,推动了对微观世界的深入探索,它可以在高分辨成像, 活细胞成像, 多荧光标记, 生物医学研究等各个方面做出贡献,尽管STED显微技术在高分辨成像方面取得了显著的进展,但它也存在一些不足之处。STED对于成本,样品要求,操作维护,技术方面等都有着一定的局限性。综合而言,尽管STED显微技术面临一些挑战,但通过技术的不断创新和改进,它仍然有望成为未来生物显微镜领域的重要工具之一。
参考文献:[1] Hell S W, Wichmann J. Breaking the diffraction resolution limit by stimulated emission: stimulated-emission-depletion fluorescence microscopy[J]. Optics letters, 1994, 19(11): 780-782.[2] Vicidomini G, Bianchini P, Diaspro A. STED super-resolved microscopy[J]. Nature methods, 2018, 15(3): 173-182.[3] 曹耀宇, 谢飞, 张鹏达, 等. 双光束超分辨激光直写纳米加工技术[J]. 光电工程, 2017, 44(12): 1133-1145. [4] Dyba, M., STED-4Pi microscopy. 2004.[5] Einstein, A., Comment on P Jordan's treatise "On the theory of quantum radiation". Zeitschrift Fur Physik, 1925. 31: p. 784-785.[6] Kastrup, L., et al., Fluorescence fluctuation spectroscopy in subdiffraction focal volumes. Physical Review Letters, 2005. 94(17).[8]Naegerl, U.V. and T. Bonhoeffer, Imaging Living Synapses at the Nanoscale by STED Microscopy. Journal of Neuroscience, 2010. 30(28): p. 9341-9346.[9]Willig, K.I., et al., Nanoscopy of Filamentous Actin in Cortical Dendrites of a Living Mouse. Biophysical Journal, 2014. 106(1): p. L01-L03.[11]Hell, S.W., Microscopy and its focal switch. Nature Methods, 2009. 6(1): p. 24-32.[12] Willig K I, Rizzoli S O, Westphal V, et al. STED microscopy reveals that synaptotagmin remains clustered after synaptic vesicle exocytosis[J]. Nature, 2006, 440(7086): 935-939.
原文标题 : 科普征文 | STED显微技术介绍和应用
图片新闻
最新活动更多
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
7.30-8.1马上报名>>> 【展会】全数会 2025先进激光及工业光电展
-
精彩回顾立即查看>> 松下新能源中国布局:锂一次电池新品介绍
-
精彩回顾立即查看>> 2024中国国际工业博览会维科网·激光VIP企业展台直播
-
精彩回顾立即查看>> CIOE中国光博会维科网·激光VIP企业展台直播
-
精彩回顾立即查看>> 2024(第五届)全球数字经济产业大会暨展览会
- 1 评测|从「超强夜景」到「一键成片」,影石Insta360 X5轻体验
- 2 OPPO、vivo、华为、荣耀入局!自有影像品牌成了香饽饽?
- 3 加州初创公司推出光学互连技术,解决AI计算的带宽问题
- 4 多光子显微镜成像技术之四十八面向神经元微环境定量化成像的多模态无标记光学显微镜
- 5 6499元起!全球首款“V单”手机发布,这配置太狠了
- 6 尼康Z5II相机体验:补上短板,新一代水桶入门全画幅微单相机
- 7 超快非线性光学技术之六十八 基于自聚焦效应提升脉冲对比度
- 8 主摄35mm!vivo X200 Ultra影像实测:放弃一英寸却赢麻了?
- 9 iPhone 17长焦大升级!苹果奋力狙击国产Ultra旗舰
- 10 【洞察】异质结量子点拥有独特光学与电学性能 我国研究成果不断增多







 分享
分享














发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论