多光子显微镜成像技术之十:偏振分辨倍频显微镜及其图像处理
在非线性光学显微镜中,二倍频(SHG)成像通常用于观测内源性纤维状结构,且SHG的强度很大程度上取决于入射光束的偏振方向与目标分子取向轴之间的相对角度。因此,基于偏振的SHG成像(P-SHG),可通过分析SHG信号强度与入射光束的偏振态之间的函数关系,来获得目标分子的结构信息。其现在已用作医学和生物学分析的重要工具。
简单的SHG图像可以通过传统的双光子激发荧光显微镜(TPM)获得。大多数TPM系统仍采用基于运动镜面的单束扫描方法,其时间分辨率取决于镜面的物理移动速度。为了实现更高速的成像,TPM系统还可以采用多束扫描的方法(图1A),其中之一便是利用转盘扫描单元。该单元由共轴的微透镜转盘和针孔转盘构成,两个转盘上的微透镜和针孔一一对应。
激光在通过微透镜转盘时,波前会覆盖多个微透镜,不同微透镜将波前各部分聚焦到不同的位置,并穿过对应的针孔,形成多个微光束。这些微光束打到样品上,可同时激发多个信号。这些信号沿显微镜系统返回并再次穿过针孔,最后被两个转盘之间的二向色镜反射到检测装置中。然而,常规使用的锁模钛宝石激光器作为光源能量不足,限制了激发光束的数量,导致使用转盘扫描单元的TPM (TPM-SD) 的有效视场 (FOV) 很小。
Ai Goto等人想通过TPM-SD系统实现高速的P-SHG成像,并保证大的FOV,故在TPM-SD系统中引入了峰值功率更高的基于Yb的激光光源。
图1是他们开发的TPM-SD系统示意图。该系统光源为基于Yb的激光器,产生的飞秒脉冲中心波长为1042 nm、平均功率4 W、脉宽300 fs,重复频率10 MHz。系统首先通过半波片和格兰激光偏振器来调节激光功率,接着通过扩束器进行扩束,扩束后的光束被引入到转盘扫描单元中,接着从扫描单元出来的多个微光束通过水浸物镜被聚焦在样品的多个点上。为了调整光束在物镜处的偏振态,激发光束的光路上放置了一个半波片和一个四分之一波片。
为了测量样品上入射光束的偏振态,在物镜后端放置了一个线性偏振膜。在这项研究中,他们使用了圆偏振光(图1B;椭圆度0.95)和4种线偏振光束(图1C-F;椭圆度0.2-0.3)。以FOV的水平轴为基准,将横向偏振角设置为0、45、90和135°。物镜收集到的荧光或SHG光通过针孔转盘,被二向色镜反射至偏振分束器。偏振分束器将信号分离为一对偏振分辨信号,它们被放大倍数为×1.2的中继透镜分别聚焦在电子倍增CCD相机的不同方形检测区域上,从而同时获取一对矩形图像。轴向扫描是通过压电驱动器实现的。
总之,该组通过TPM-SD系统,开发了一种高速的偏振分辨成像方法。他们使用该系统对固定的小鼠皮肤样品和骨骼肌样品(离体)以及活体小鼠的骨骼肌进行了成像,证明了该系统能以56 Hz的时间分辨率对体内组织成像,获取胶原纤维的结构信息。
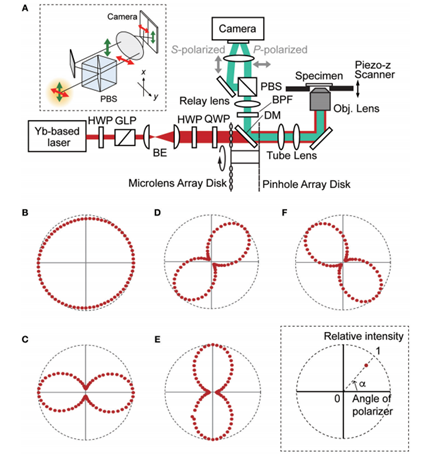
图1 (A) TPM-SD系统;(B–F) 通过调整HWP和QWP的位置,改变入射光脉冲在样品上的偏振态。[1]
非线性成像技术的优化,除了基于图像获取模式的优化,还可以从先进的图像处理算法入手。发展图像的实时分析工具,以帮助病理学家快速表征组织特性,实现自动化的病症诊断,具有极大的推动医学发展的潜力。目前,用于自动提取疾病特征的用户独立算法引起了越来越多的关注。2019年,Riccardo Scodellaro等人开发了一种针对P-SHG的图像处理方法——μMAPPS(Microscopic Multiparametric Analysis by Phasor projection of Polarization-dependent SHG signal)。其原理是对每个像素的随入射光偏振态变化的SHG信号()进行二维相量分析,从中分析出各像素对应胶原蛋白纤维的平均取向角 (θF)和极化率各向异性参数(γ,极化率张量χ(2)的非对角线和对角线元素的比),并依此获得组织细胞外基质(ECM)中胶原蛋白的微结构信息。
该组的最终目标为无人员操作,全自动化,基于μMAPPS算法的病理学诊断:通过区分不同组织中不同的胶原蛋白结构,来区分正常组织和癌变组织。具体方法为,先通过μMAPPS重构每个像素的和信息,接着,将整个图像划分为包含大量感兴趣区域(ROI)的网格,对每个ROI的所有像素应用聚类算法,将和类似的像素归为一类(簇),至此,每个ROI的像素都被分为了数十个簇,然后,基于不同ROI中不同的分簇,定义一组参数 (p参数:簇数(NC),簇元素比(CER,每个簇与最大像素数量的簇,所含像素数量之比),和熵(S)), 以量化各ROI中胶原蛋白结构的无序性。
最后,以所有ROI参数的平均值为基准,将各ROI区分为正常组织或癌变组织,并对应投影回原图像中。图2是基于熵值的肿瘤边缘分割结果。该组通过研究CT26(结肠癌)和4T1(乳腺癌)两种癌症模型,测试了该方法自动区分肿瘤和健康组织区域的准确率,并证明熵是在同一组织类型内,区分肿瘤与健康区域,判别肿瘤边缘的最佳参数。
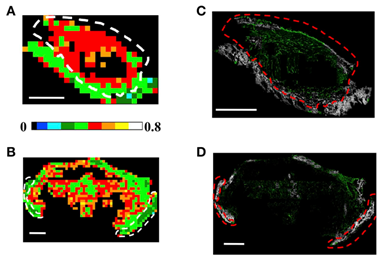
图2 (A, B) 基于熵(S)的感兴趣区域(ROI)的分析结果。每个150×150 ?m2的ROI(A, B)都按照图例进行了颜色编码,以表示CT26的癌变区域(A)和4T1的癌变区域(B),及其中检索到的熵值。(C, D) 将ROI分析结果反投影到CT26 (C)和4T1 (D) 肿瘤模型的原图像平面,并分割出癌变部分的图像。红色虚线表示肿瘤和正常组织的边界。 [2]
参考文献
[1] 2019. Ai Goto?, Kohei Otomo? and Tomomi Nemoto. Real-Time Polarization-Resolved Imaging of Living Tissues Based on Two-Photon Excitation Spinning-Disk Confocal Microscopy
[2] 2019. Riccardo Scodellaro, Margaux Bouzin, Francesca Mingozzi, Laura D’Alfonso,Francesca Granucci, Maddalena Collini, Giuseppe Chirico? and Laura Sironi?. Whole-Section Tumor Micro-Architecture Analysis by a Two-Dimensional Phasor-Based Approach Applied to Polarization-Dependent Second Harmonic Imaging
图片新闻
最新活动更多
-
7月30-31日报名参会>>> 全数会2025中国激光产业高质量发展峰会
-
7.30-8.1马上报名>>> 【展会】全数会 2025先进激光及工业光电展
-
精彩回顾立即查看>> 松下新能源中国布局:锂一次电池新品介绍
-
精彩回顾立即查看>> 2024中国国际工业博览会维科网·激光VIP企业展台直播
-
精彩回顾立即查看>> CIOE中国光博会维科网·激光VIP企业展台直播
-
精彩回顾立即查看>> 2024(第五届)全球数字经济产业大会暨展览会
- 1 评测|从「超强夜景」到「一键成片」,影石Insta360 X5轻体验
- 2 主摄35mm!vivo X200 Ultra影像实测:放弃一英寸却赢麻了?
- 3 【聚焦】高重频飞秒激光器研制难度大 我国政策推动相关技术研究不断深入
- 4 6499元起!全球首款“V单”手机发布,这配置太狠了
- 5 努比亚Z70S Ultra摄影师版实测:功底扎实,还很独特
- 6 超快非线性光学技术之六十八 基于自聚焦效应提升脉冲对比度
- 7 尼康Z5II相机体验:补上短板,新一代水桶入门全画幅微单相机
- 8 【洞察】异质结量子点拥有独特光学与电学性能 我国研究成果不断增多
- 9 超快非线性光学技术之六十九 基于空气中锥形辐射实现飞秒脉冲自压缩
- 10 光子技术催化数据中心AI升级:从光纤连接到共封装光学







 分享
分享














发表评论
请输入评论内容...
请输入评论/评论长度6~500个字
暂无评论
暂无评论